Lynn Huỳnh – (VNTB) -Một triệu liều vắc xin Vero Cell của Sinopharm phải chờ thủ tục kiểm định xong mới biết là có thể được sử dụng hay không?
***
Sáng 3-8, Ban chỉ đạo phòng, chống dịch COVID-19 TP.HCM đã tổ chức họp báo thông tin về công tác phòng, chống dịch COVID-19. Trao đổi tại cuộc họp, Phó chủ tịch UBND TP.HCM Dương Anh Đức cho biết hiện nay 1 triệu liều vắc xin Sinopharm mới về TP.HCM. Đây là lượng vắc xin được nhà tài trợ tặng cho TP.HCM.
Hiện theo quy định của Bộ Y tế, đơn vị nhập khẩu đã gửi các cơ quan chức năng kiểm định đúng quy trình lô vắc xin này. Sau đó, chính quyền sẽ phân bổ tổ chức tiêm trên tinh thần tự nguyện, những người đồng ý tiêm sẽ được tiêm.
Theo ông Đức, những ngày qua ông nhận được tin nhắn hỏi về việc có bắt buộc người dân tiêm vắc xin Trung Quốc. Tại cuộc họp, ông Đức khẳng định chủ trương lâu nay của cả nước là tiêm miễn phí và tự nguyện cho toàn dân. Các loại vắc xin được tiêm phải đáp ứng hai yêu cầu là được WHO cấp phép sử dụng khẩn cấp và được Việt Nam cấp phép sử dụng.
Như vậy, nếu người dân từ chối vắc xin Trung Quốc, họ được quyền không tiêm và có thể chọn thời điểm tiêm thích hợp khác với vắc xin không phải của Trung Quốc.
Thắc mắc đặt ra: giả dụ kết quả kiểm định cho biết vắc xin này không phù hợp sử dụng cho tiêm ngừa đối với biến chúng delta, vậy thì xử lý ra sao 1 triệu liều Vero Cell đó?
Theo luật định, các vắc xin nhập khẩu vào Việt Nam đều phải tuân thủ các quy định của Việt Nam. Các vắc xin này phải thực hiện các thủ tục để đăng ký lưu hành bao gồm các thử nghiệm cần thiết và đảm bảo đạt được các tiêu chuẩn theo quy định của Việt Nam và của Tổ chức Y tế thế giới.
Vắc xin chỉ được cấp phép sử dụng tại Việt Nam sau khi đã được kiểm định đạt được các yêu cầu của Việt Nam và thực hiện tất cả các thủ tục cần thiết. Từng lô vắc xin khi nhập vào Việt Nam đều phải được Viện Kiểm định quốc gia Vắc xin và Sinh phẩm y tế kiểm định và đạt tiêu chuẩn về an toàn, trước khi đưa vào sử dụng.
Thông tư số 11/2018/TT-BYT quy định về chất lượng thuốc, nguyên liệu làm thuốc, ở điều 11.2, ghi:
“Đối với vắc xin, sinh phẩm là huyết thanh chứa kháng thể, dẫn xuất của máu và huyết tương người nhập khẩu: Cơ sở nhập khẩu phải gửi hồ sơ sản xuất và mẫu của lô sản phẩm tới Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế bao gồm:
a) Phiếu gửi mẫu kiểm nghiệm;
b) Mẫu vắc xin, sinh phẩm để kiểm nghiệm (số lượng mẫu đối với từng loại vắc xin, sinh phẩm theo quy định tại Hướng dẫn của Bộ Y tế về kiểm nghiệm xuất xưởng vắc xin, sinh phẩm là huyết thanh chứa kháng thể, dẫn xuất của máu và huyết tương người);
c) Hồ sơ tóm tắt sản xuất và kiểm tra chất lượng của lô vắc xin, sinh phẩm nhập khẩu (bản sao có đóng dấu xác nhận của cơ sở sản xuất hoặc của cơ sở nhập khẩu);
d) Giấy chứng nhận chất lượng của cơ quan có thẩm quyền nước xuất khẩu kèm theo đối với từng lô vắc xin, sinh phẩm nhập khẩu (bản sao có đóng dấu xác nhận của cơ sở nhập khẩu);
đ) Bảng dữ liệu theo dõi điều kiện bảo quản (dây chuyền lạnh) trong quá trình vận chuyển lô hàng nhập khẩu (có đóng dấu xác nhận của cơ sở nhập khẩu) từ các thiết bị tự ghi nhiệt độ, kết quả chỉ thị đông băng (nếu có)”.
Khoản 3, điều 11, nhấn mạnh và đây cũng chính là nội dung có lẽ phía nhập khẩu vắc xin Vero Cell ngần ngại nhất cho yêu cầu pháp lý y khoa: “Cơ sở sản xuất, cơ sở nhập khẩu phải chịu trách nhiệm về tính pháp lý của các tài liệu do cơ sở cung cấp”.
Thời gian và trình tự cụ thể cho kiểm nghiệm đánh giá lô vắc xin Vero Cell, như sau (lược trích):
Bước 1: Cơ sở sản xuất phải gửi mẫu và hồ sơ sản xuất vắc xin, sinh phẩm là huyết thanh chứa kháng thể, dẫn xuất của máu và huyết tương người đến Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế để kiểm nghiệm đánh giá trước khi đưa ra lưu hành.
Bước 2: Sau khi nhận đủ mẫu và hồ sơ Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế tiến hành rà soát hồ sơ, tiến hành kiểm nghiệm mẫu vắc xin, sinh phẩm gửi tới, cụ thể:
a) Trong thời hạn tối đa 15 ngày, kể từ ngày nhận được mẫu thuốc, cơ sở kiểm nghiệm phải trả lời kết quả kiểm nghiệm, phân tích mẫu thuốc được lấy bởi cơ quan kiểm tra chất lượng trong các trường hợp sau: Thuốc có thông tin về phản ứng có hại nghiêm trọng; Thuốc của cơ sở có vi phạm nghiêm trọng về đáp ứng Thực hành tốt;…
b) Trong thời hạn tối đa 20 ngày, kể từ ngày nhận được mẫu thuốc, cơ sở kiểm nghiệm phải trả lời kết quả kiểm nghiệm, phân tích trong trường hợp sau: Thuốc phải kiểm nghiệm trước khi lưu hành…
c) Trong thời hạn tối đa 30 ngày, kể từ ngày nhận được mẫu thuốc, nguyên liệu làm thuốc, cơ sở kiểm nghiệm phải trả lời kết quả kiểm nghiệm, phân tích mẫu trong các trường hợp sau: Thuốc, nguyên liệu làm thuốc có các phép thử có yêu cầu về thời gian thử nghiệm kéo dài; Thuốc, nguyên liệu làm thuốc có tiêu chuẩn chất lượng cần thẩm định lại hoặc đánh giá lại kết quả kiểm nghiệm; Thuốc, nguyên liệu làm thuốc có nghi ngờ về thành phần, chất lượng, phải áp dụng phương pháp kiểm nghiệm khác với phương pháp ghi trong tiêu chuẩn chất lượng đã đăng ký; Thuốc, nguyên liệu làm thuốc có phép thử mà cơ sở kiểm nghiệm không có đủ điều kiện thử nghiệm (ví dụ: thiếu thiết bị máy móc, hóa chất, thuốc thử, chất chuẩn).
d) Trường hợp không đáp ứng được thời hạn trả lời kết quả phân tích, kiểm nghiệm theo quy định tại các Điểm a, b và c bước này, cơ sở kiểm nghiệm phải giải trình lý do tại văn bản kèm theo phiếu kiểm nghiệm, phiếu phân tích;
Bước 3: Trong thời hạn 24 giờ, kể từ thời điểm ban hành phiếu kiểm nghiệm hoặc phiếu phân tích, cơ sở kiểm nghiệm phải gửi phiếu kiểm nghiệm hoặc phiếu phân tích tới cơ quan kiểm tra chất lượng, cơ sở sản xuất, cơ sở nhập khẩu có thuốc, nguyên liệu làm thuốc được lấy mẫu và cơ sở được lấy mẫu.
(…) Viện Kiểm định Quốc gia vắc xin và sinh phẩm y tế cấp giấy chứng nhận chất lượng theo quy định, trong đó chỉ rõ các nội dung đáp ứng hoặc không đáp ứng yêu cầu và kết luận về chất lượng, an toàn, hiệu quả của lô vắc xin, sinh phẩm.
Như vậy, thời gian tối đa cho kiểm định lô Vero Cell hiện có ở TP.HCM, rất có thể là ngày 2-9-2021.

































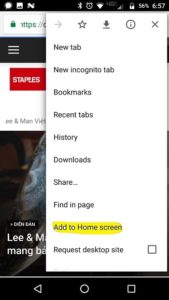
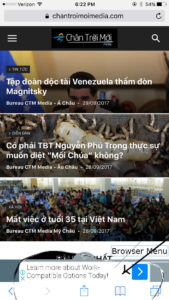 2/ Mở menu của Safari, nơi cuối màn hình, ô có mũi tên, kéo về phía trái cho đến khi thấy ô “Add to home screen”.
2/ Mở menu của Safari, nơi cuối màn hình, ô có mũi tên, kéo về phía trái cho đến khi thấy ô “Add to home screen”.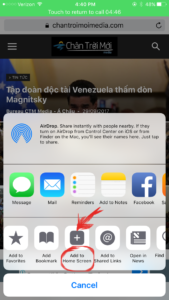 Bấm ô đó là xong. Bạn đã có icon ngay trên home screen như hình bên dưới.
Bấm ô đó là xong. Bạn đã có icon ngay trên home screen như hình bên dưới.